Während der Covid-Pandemie gab die US-Regierung Milliarden von Dollar für fast 400 Produkte aus, die Hunderte Millionen Menschen schützen, diagnostizieren und behandeln sollen – alle mit der Bezeichnung „EUA“ oder „Emergency Use Authorization“.
Doch was bedeutet eigentlich EUA?
Noch bevor wir diese Frage beantworten und um zu verstehen, wo die EUA im Verhältnis zu anderen Wegen zur Zulassung oder Zulassung von Medizinprodukten steht, ist es hilfreich, einen Blick darauf zu werfen was EUA nicht ist:
EUA ist keine Bezeichnung für ein experimentelles Produkt, das sich in einer klinischen Studie befindet
Wenn wir nur eines über EUA verstehen, dann sollte es Folgendes sein: EUA gilt nicht für ein Produkt, das sich einer klinischen Studie unterzieht, die den FDA-Vorschriften oder anderen gesetzlichen Anforderungen unterliegt.
EUA ist auch nicht dasselbe wie Expanded Access Use (EAU), oft auch „Compassionate Use“-Zugang genannt, bei dem es darum geht, Patienten mit schweren, unheilbaren Krankheiten Zugang zu experimentellen Produkten zu gewähren, bevor diese vollständig zugelassen sind.
Diese Tabelle von einem Präsentation der FDA-CDC 2020 fasst die Unterschiede zwischen Produkten zusammen, die sich in klinischen Studien befinden, Produkten, die Patienten über einen erweiterten „mitfühlenden“ Zugang verabreicht werden, und Produkten, die über die EUA zugelassen sind:
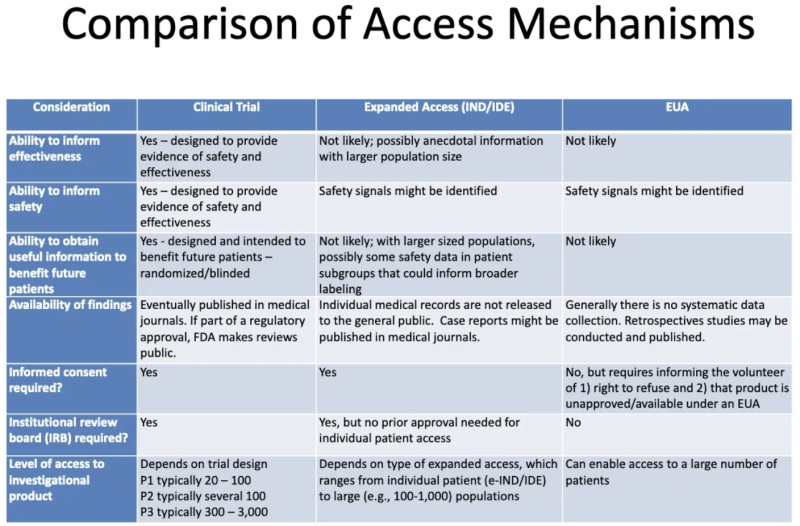
Das sagt uns diese Tabelle über EUA:
- Der Prozess der EUA-Gewährung wird wahrscheinlich keine Informationen über die Wirksamkeit eines Produkts liefern.
- Der Prozess der EUA-Gewährung ist nicht darauf ausgelegt, einen Nachweis der Sicherheit oder Wirksamkeit zu erbringen, es können jedoch Sicherheitssignale identifiziert werden.
- Es ist unwahrscheinlich, dass nach Erhalt der EUA für ein Produkt und der Verabreichung an einige Patienten nützliche Informationen gewonnen werden, die künftigen Patienten zugute kommen.
- Es gibt keine systematische Datenerhebung zur Wirksamkeit oder Sicherheit von EUA und im Rahmen des behördlichen Zulassungsverfahrens werden keine Daten in medizinischen Fachzeitschriften veröffentlicht.
- Es ist keine Einverständniserklärung erforderlich, aber Patienten, die sich „freiwillig“ zur Einnahme des Produkts bereit erklären, müssen darüber informiert werden, dass sie dies ablehnen können und dass das Produkt nicht gemäß EUA zugelassen/verfügbar ist.
- Es ist kein Institutional Review Board (IRB) erforderlich. [IRB ist ein Gremium, das das Wohlergehen menschlicher Probanden in klinischen Studien schützen soll]
Um noch weiter zu verdeutlichen, wie getrennt EUA von jedem normalen Genehmigungsprozess ist, in a 2009 Veröffentlichung des Institute of Medicine der National Academiesfinden wir diese Aussage:
Es ist wichtig zu erkennen, dass eine EUA nicht Teil des Entwicklungspfades ist; Dabei handelt es sich um eine völlig separate Einheit, die nur in Notfällen zum Einsatz kommt und nicht Teil des Arzneimittelzulassungsverfahrens ist. (S. 28)
Um es zusammenzufassen:
Es ist unwahrscheinlich, dass der Prozess der Erteilung einer EUA für ein Produkt einen Nachweis der Sicherheit oder Wirksamkeit erbringen wird. Sobald für ein Produkt eine EUA erteilt und es Patienten verabreicht wird, ist es unwahrscheinlich, dass nützliche Informationen zum Nutzen zukünftiger Patienten gewonnen werden, da keine systematische Datenerfassung zur Wirksamkeit oder Sicherheit erfolgt.
Basierend auf all diesen sehr klaren Informationen der CDC/FDA und der IMNA kann man mit Fug und Recht zu dem Schluss kommen, dass es sich bei der Notfallgenehmigung um einen Prozess handelt, der sehr umsichtig und nur in dringenden Notfällen angewendet werden sollte.
Schauen wir uns nun an, für welche Arten von Notfallsituationen EUA gesetzlich vorgesehen ist.
EAU ist für Notfälle mit Massenvernichtungswaffen gedacht
Die Gesetze, die den oben beschriebenen EUA-„Zugangsmechanismus“ zulassen, wurden für Fälle extremer, unmittelbarer Notfälle im Zusammenhang mit Massenvernichtungswaffen (WMD), auch CBRN-Kampfstoffe (chemische, biologische, radiologische, nukleare) genannt, erarbeitet.
Hier erfahren Sie, wie die Food & Drug Administration vorgeht (FDA) beschreibt seine EUA-Befugnisse:
Abschnitt 564 des FD&C Act (21 USC 360bbb–3) ermöglicht es der FDA, den Schutz der öffentlichen Gesundheit vor biologischen, chemischen, nuklearen und radiologischen Stoffen zu stärken.
Mit dieser EUA-Berechtigung kann die FDA dazu beitragen, sicherzustellen, dass in Notfällen medizinische Gegenmaßnahmen zur Diagnose, Behandlung oder Vorbeugung schwerer oder lebensbedrohlicher Krankheiten oder Zustände eingesetzt werden können, die durch biologische, chemische, nukleare oder radiologische Stoffe verursacht werden, wenn keine geeigneten, zugelassenen Maßnahmen vorliegen und verfügbare Alternativen (neben anderen Kriterien).
Diese EUA-Befugnisse wurden 2004 unter ganz besonderen Umständen im Zusammenhang mit der Vorbereitung auf Angriffe durch CBRN-Agenten gewährt.
Wie erklärt im Bill of Health von Harvard Law,
Letztlich war es der Krieg gegen den Terror, der zu einer Notfallgenehmigung führte. Nach den Ereignissen vom 11. September 2001 und den darauffolgenden Anthrax-Postanschlägen erließ der Kongress das Project Bioshield Act von 2004.
Das Rekord weist darauf hin, dass sich der Kongress speziell auf die Bedrohung durch Bioterror konzentrierte und nicht auf die Vorbereitung auf eine natürlich auftretende Pandemie.
Angesichts einer so begrenzten Art wirklich extremer Notfallsituation im Zusammenhang mit einem Massenvernichtungswaffenangriff ist es verständlich, warum der EUA-Zugriffsmechanismus keine große behördliche Aufsicht oder die Einhaltung von Herstellungs- oder klinischen Studienstandards erfordert.
Was erfordert der EUA-Zugriffsmechanismus eigentlich?
Die 3 Schritte zur Notfallgenehmigung (EUA)
Damit einem Medizinprodukt eine EUA gewährt werden kann, müssen drei Dinge geschehen:
- Der Heimatschutzminister, der Verteidigungsminister oder der Minister für Gesundheit und menschliche Dienste müssen feststellen, dass ein Notfall im Zusammenhang mit einem Angriff oder der Gefahr eines Angriffs mit einem CBRN-Erreger oder einer durch einen solchen Erreger verursachten Krankheit vorliegt.
- Die FDA muss sicherstellen, dass sie bei der Ausstellung der EUA vier „gesetzliche Kriterien“ erfüllt.
- Die FDA muss in der EUA „bestimmte erforderliche Bedingungen festlegen“.
EUA Schritt 1: Ausrufen eines CBRN-Notfalls
Die Notfallerklärung für EUA ist separat und hat nichts mit anderen Notfallerklärungen zu tun, die vom Präsidenten, dem HHS-Sekretär oder einer anderen Person ausgestellt werden können. Sie muss speziell zum Zweck der Aktivierung der EUA ausgestellt werden und kann unabhängig von einer anderen Notfallerklärung beendet oder verlängert werden.
Hier ist, was Das EUA-Gesetz besagt sind die vier möglichen Szenarien für die Aktivierung des EUA-Zugriffsmechanismus:
- eine Feststellung des Heimatschutzministers, dass ein innerstaatlicher Notfall vorliegt oder ein erhebliches Potenzial für einen innerstaatlichen Notfall besteht, der ein erhöhtes Risiko eines Angriffs mit einem oder mehreren biologischen, chemischen, radiologischen oder nuklearen Kampfstoffen birgt;
- eine Feststellung des Verteidigungsministers, dass ein militärischer Notfall vorliegt oder ein erhebliches Potenzial für einen militärischen Notfall besteht, der ein erhöhtes Risiko mit sich bringt Vereinigt Staaten Streitkräfte, einschließlich Personal, das unter der Autorität von Titel 10 oder Titel 50 operiert, eines Angriffs mit –
- ein oder mehrere biologische, chemische, radiologische oder nukleare Stoffe; oder
- ein oder mehrere Vertreter, die ein unmittelbar lebensbedrohliches und spezifisches Risiko für United darstellen können oder anderweitig damit verbunden sind Staaten Streitkräfte;
- eine Bestimmung durch die Sekretärin [des Gesundheits- und Sozialwesens], dass ein Notfall im Bereich der öffentlichen Gesundheit vorliegt oder ein erhebliches Potenzial für einen Notfall im Bereich der öffentlichen Gesundheit besteht, der die nationale Sicherheit oder die Gesundheit und Sicherheit von Personen beeinträchtigt oder erheblich beeinträchtigen kann Vereinigt Staaten im Ausland lebende Bürger, bei denen es sich um einen oder mehrere biologische, chemische, radiologische oder nukleare Wirkstoffe oder eine Krankheit oder einen Zustand handelt, der auf diesen oder diese Wirkstoffe zurückzuführen sein könnte; oder
- die Feststellung einer materiellen Bedrohung gemäß Abschnitt 319F–2 des Gesetz über das öffentliche Gesundheitswesen [42 USC 247d–6b] ausreichend, um die nationale Sicherheit oder die Gesundheit und Sicherheit von zu beeinträchtigen Vereinigt Staaten im Ausland lebende Bürger.
EUA Schritt 2. Erfüllung der gesetzlichen Kriterien
Sobald einer der Sekretäre erklärt hat, dass ein Notfall vorliegt, der eine EUA rechtfertigt, müssen vier weitere „gesetzliche Kriterien“ erfüllt sein, damit die FDA die EUA ausstellen kann. So erklärt die FDA diese Anforderungen:
- Schwere oder lebensbedrohliche Krankheit oder Zustand
Damit die FDA eine EUA ausstellen kann, müssen die in der EUA-Erklärung des HHS-Sekretärs genannten CBRN-Wirkstoffe in der Lage sein, eine schwere oder lebensbedrohliche Krankheit oder einen schweren oder lebensbedrohlichen Zustand zu verursachen.
- Wirksamkeitsnachweis
Medizinische Produkte, die für eine EUA in Betracht gezogen werden können, sind solche, die „wirksam sein können“, um schwere oder lebensbedrohliche Krankheiten oder Zustände zu verhindern, zu diagnostizieren oder zu behandeln, die durch einen oder mehrere CBRN-Wirkstoffe verursacht werden können, die in der Erklärung des HHS-Sekretärs aufgeführt sind Notfall oder drohender Notfall gemäß Abschnitt 564(b).
Der „kann wirksam sein“-Standard für EUAs sieht ein geringeres Maß an Beweisen vor als der „Wirksamkeits“-Standard, den die FDA für Produktzulassungen verwendet. Die FDA beabsichtigt, die potenzielle Wirksamkeit eines möglichen EUA-Produkts von Fall zu Fall anhand einer Risiko-Nutzen-Analyse zu bewerten, wie unten erläutert.
[Fettschrift hinzugefügt]
- Risiko-Nutzen-Analyse
Ein Produkt kann für eine EUA in Betracht gezogen werden, wenn der Kommissar feststellt, dass die bekannten und potenziellen Vorteile des Produkts bei Verwendung zur Diagnose, Vorbeugung oder Behandlung der identifizierten Krankheit oder des festgestellten Zustands die bekannten und potenziellen Risiken des Produkts überwiegen.
Bei der Feststellung, ob die bekannten und potenziellen Vorteile des Produkts die bekannten und potenziellen Risiken überwiegen, hat die FDA will schauen die Gesamtheit der wissenschaftlichen Erkenntnisse heranzuziehen, um eine Gesamtrisiko-Nutzen-Beurteilung vorzunehmen. Solche Beweise, die entstehen könnte aus verschiedenen Quellen, könnte beinhalten (ist aber nicht beschränkt auf): Ergebnisse in- und ausländischer klinischer Studien, In-vivo-Wirksamkeitsdaten aus Tiermodellen und In-vitro-Daten, zur Prüfung durch die FDA verfügbar. Die FDA wird auch die Qualität und Quantität bewerten verfügbare Beweise, angesichts des aktuellen Stands der wissenschaftlichen Erkenntnisse.
[Fettschrift hinzugefügt]
- Keine Alternativen
Damit die FDA eine EUA ausstellen kann, darf es keine angemessene, zugelassene und verfügbare Alternative zum Kandidatenprodukt zur Diagnose, Vorbeugung oder Behandlung der Krankheit oder des Leidens geben. Ein potenzielles Alternativprodukt kann als „nicht verfügbar“ betrachtet werden, wenn nicht genügend Vorräte der zugelassenen Alternative vorhanden sind, um den Notfallbedarf vollständig zu decken.
EUA Schritt 3. Auferlegen der erforderlichen Bedingungen
Sobald wir die EUA-spezifische Notfallerklärung haben und sobald die FDA feststellt, dass das Produkt wirksam sein könnte und dass alle verfügbaren Beweise zeigen, dass sein Nutzen seine Risiken überwiegt, gibt es eine weitere Ebene damit verbundener Regulierung.
Hier ist, wie ein Bericht des Congressional Research Service 2018 über EUA erklärt das:
FFDCA §564 weist die FDA an, bestimmte erforderliche Bedingungen in einer EUA aufzuerlegen, und lässt gegebenenfalls zusätzliche Ermessensbedingungen zu. Die erforderlichen Bedingungen variieren je nachdem, ob es sich bei der EUA um ein nicht zugelassenes Produkt oder um die nicht genehmigte Verwendung eines zugelassenen Produkts handelt. Für ein nicht zugelassenes Produkt müssen die Nutzungsbedingungen:
(1) sicherstellen, dass medizinische Fachkräfte, die das Produkt verabreichen, die erforderlichen Informationen erhalten;
(2) sicherstellen, dass Personen, denen das Produkt verabreicht wird, die erforderlichen Informationen erhalten;
(3) für die Überwachung und Meldung unerwünschter Ereignisse im Zusammenhang mit dem Produkt sorgen; Und
(4) eine Aufzeichnung und Berichterstattung durch den Hersteller vorsehen.
Zusammenfassung
Wie in diesem Artikel erwähnt, erkennen die FDA/CDC eindeutig an, dass der Prozess der Erteilung einer Notfallgenehmigung (Emergency Use Authorization, EUA) wahrscheinlich keine Informationen über die Wirksamkeit oder Sicherheit eines Produkts generieren wird. Wenn wir uns den Buchstaben des EUA-Gesetzes ansehen, sehen wir, dass dies tatsächlich eine korrekte Einschätzung ist.
Das EUA-Gesetz schreibt keine gesetzlichen oder behördlichen Standards vor, die darüber entscheiden könnten, ob ein Produkt sicher oder wirksam ist. Die einzigen Standards bestehen darin, ob die FDA glaubt, dass das Produkt wirksam sein könnte und ob seine bekannten Vorteile seine bekannten Schäden überwiegen. Wenn keine bekannten Schäden oder bekannten Vorteile vorliegen, weil das Produkt noch nie das Arzneimittelzulassungsverfahren durchlaufen hat, kann die FDA für diese Entscheidung beliebige Informationen oder Standards verwenden.
Aus alledem folgt, dass ein Unternehmen, dessen Produkt für eine EUA in Frage kommt, versuchen kann, die Sicherheit und/oder Wirksamkeit des Produkts mit den von ihm gewählten Mitteln nachzuweisen. Die Existenz eines solchen Versuchs (sei es eine klinische Studie oder ein anderer Datenerfassungsmechanismus) und die Art und Weise, wie dieser Versuch durchgeführt wird, liegt ganz im Ermessen des Unternehmens. Nichts im EUA-Gesetz gilt für die Art und Weise, wie das Unternehmen Studien oder andere Datenerfassungsmechanismen entwirft, durchführt oder analysiert, die es verfolgt.
Auf Covid-Produkte übertragen heißt das:
- Es waren keine Sicherheits- oder Wirksamkeitsdaten aus klinischen Studien erforderlich, damit Covid-Produkte EUA erhalten konnten.
- Alle im EUA-Prozess genannten klinischen Studien wurden ohne gesetzlich geltende regulatorische Standards durchgeführt.
- Wenn wir feststellen, dass es diesen Produkten an Wirksamkeit oder Sicherheit mangelt, ist das keine Überraschung. Es ist ein höchstwahrscheinliches Ergebnis des Prozesses.
- Es liegen keine Daten aus dem EUA-Prozess vor, auf deren Grundlage Nicht-EUA-Entscheidungen über die Sicherheit oder Wirksamkeit des Produkts getroffen werden könnten. Daher müsste für jede Nicht-EUA-Verwendung des Produkts von Anfang an das gesetzliche Zulassungsverfahren für reguläre Medizinprodukte durchlaufen werden.
Mehr zum Zulassungsverfahren für Covid-Impfstoffe hier.
Wiederveröffentlicht von der Autorin Substack
Veröffentlicht unter a Creative Commons Namensnennung 4.0 Internationale Lizenz
Für Nachdrucke setzen Sie bitte den kanonischen Link wieder auf das Original zurück Brownstone-Institut Artikel und Autor.









