Diese Woche hat die US-amerikanische Food and Drug Administration (FDA) autorisiert die Anwendung einer einzelnen Auffrischimpfung des Covid-19-Impfstoffs von Pfizer bei Kindern im Alter von 5 bis 11 Jahren, mindestens fünf Monate nach Abschluss einer Grundimmunisierung. Es wird erwartet, dass der Beratungsausschuss der CDC die Entscheidung heute absegnet.
Laut der FDA stammten die Beweise, die ihrer Entscheidung zugrunde lagen, von einer Untergruppe von 67 Kindern, die Teil einer laufenden Studie waren und 7-9 Monate nach ihrer Grundimmunisierung geboostert wurden. Sie zeigten einen Monat nach der Auffrischimpfung höhere Antikörperspiegel als vor der Auffrischimpfung.
Die Entscheidung der FDA ist aus mehreren Gründen kühn.
Fehlen von Daten
Gerade als die FDA bessere Daten fordern sollte, senkt die Behörde ihre Standards.
Keine rigorosen Studien in dieser Altersgruppe haben gezeigt, dass eine dritte Dosis wichtige Folgen wie Krankenhausaufenthalte und Todesfälle reduzieren kann – die randomisierten klinischen Studien wurden nicht durchgeführt, obwohl Pfizer Milliardeneinnahmen erzielt.
Stattdessen basierte die Entscheidung auf dem Vorhandensein von „neutralisierenden Antikörpern“, da diese leicht zu messen und zu untersuchen sind. Die Antikörperspiegel schwinden nicht nur schnell, sie korrelieren auch nicht unbedingt mit dem Schutz.
Die eigene der FDA Website sagt, dass „Antikörpertests nicht verwendet werden sollten, um das Immunitätsniveau oder den Schutz einer Person vor Covid-19 zu bewerten“. Und doch hat die Agentur genau das getan.
Dies folgt dem vorherigen technische Daten aus New York während des Omicron-Anstiegs, aus dem hervorgeht, dass die Wirksamkeit des Impfstoffs von Pfizer bei 5- bis 11-Jährigen von 68 % Mitte Dezember 2021 auf nur noch 12 % im Januar 2022 gesunken ist und damit deutlich unter dem ursprünglichen Schwellenwert der FDA von 50 % liegt.
Der kurzsichtige Fokus von Arzneimittelbehörden und Gesundheitsbehörden auf Antikörper ging zu Lasten der Berücksichtigung anderer wichtiger Aspekte des Immunsystems wie CD4+ T-Zellen und natürlicher Killerreaktionen, die eine entscheidende Rolle bei der Verhinderung von Infektionen spielen und vermutlich auch sind haltbarer als Antikörper. Leider wurden diese Daten von den Behörden weitgehend ignoriert.
Dr. Peter Marks, Direktor des Center for Biologics Evaluation and Research der FDA bestätigte dies Daten zeigen zunehmend dass der Schutz nach zwei Dosen mit der Zeit nachlässt und dass eine dritte Impfung dazu beitragen könnte, den Schutz für Kinder in der Altersgruppe von 5 bis 11 Jahren zu verbessern, da der „Nutzen die Risiken überwiegt“.
In Bezug auf die Sicherheit hat die FDA jedoch nur etwa 400 Kinder untersucht, die eine Auffrischungsdosis erhalten haben, und ernsthafte, seltene Schäden würden bei einer so kleinen Stichprobengröße nicht entdeckt.
Ignorieren der natürlichen Immunität
Die Zulassung einer dritten Dosis für alle 5- bis 11-Jährigen – von denen die meisten bereits über eine natürliche Immunität verfügen – bringt wahrscheinlich keinen weiteren Nutzen und kann sie unnötigen Schäden aussetzen.
Die US CDC berichtet dass etwa 75 % der Kinder und Jugendlichen serologische Beweise (Antikörper) von einer früheren Infektion haben und daher bereits einen robusten und dauerhaften Schutz gegen Covid-19 entwickelt haben.
Die britische Regierung geschätzt dass über 85 % der Kinder im Alter von 5–11 Jahren bis Januar 19 an Covid-2022 erkrankt waren und dass ihre erworbene natürliche Immunität Schutz vor schweren Krankheiten oder einer zukünftigen erneuten Infektion bieten würde.
Marty Makary, Professor an der Johns Hopkins School of Medicine schrieb im Wall Street Journal, dass die natürliche Immunität bei Kindern angesichts ihres stärkeren Immunsystems wahrscheinlich sehr robust ist. Er sagte, wenn ein Kind bereits Covid-19 gehabt hätte, „gäbe es keine wissenschaftliche Grundlage für eine Impfung“.
Er stellte auch fest, dass weder in der geimpften Gruppe noch in der Placebogruppe Fälle von Covid-19 bei Kindern dokumentiert wurden, die zuvor während der Pfizer-Studie mit SARS-CoV-2 infiziert worden waren, was den Nutzen der natürlichen Immunität verstärkt.
Beratungsgremium
Das Vaccines and Related Biological Products Advisory Committee (VRBPAC) bietet der Behörde nicht nur Einblicke und Fachwissen, sondern verleiht dem Entscheidungsprozess der FDA Glaubwürdigkeit und Vertrauenswürdigkeit.
Allerdings hat die FDA ihr Beratungsgremium diese Woche nicht einberufen und erklärt, dass sie bereits bei einem früheren Treffen über Auffrischungsimpfstoffe gesprochen habe und dass eine weitere Diskussion keinen Nutzen bringen würde.
Einige Mitglieder haben Bedenken geäußert, dass die Arzneimittelbehörde wiederholt Entscheidungen über Auffrischungsdosen getroffen hat, ohne offene öffentliche Diskussionen abzuhalten, und sagen, dass sich die Behörde immer weniger auf ihre unabhängigen Experten verlässt, bevor sie Medikamente zulässt.
In einer aktuelle Analyse, zeigten Forscher, dass im Jahr 6 nur 2021 % der von der FDA zugelassenen Arzneimittel von Beratungsgremien überprüft wurden, verglichen mit 55 % im Jahr 2010 (siehe Abbildung).
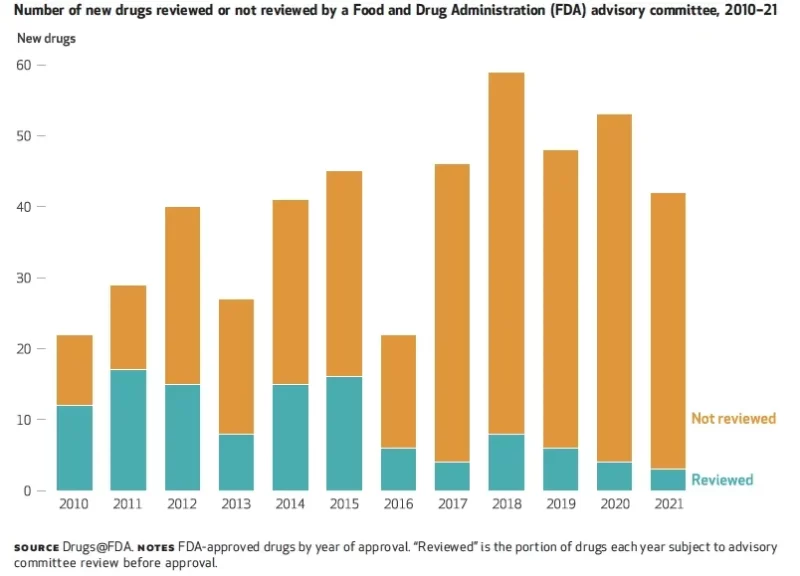
Wenn das Vertrauen der Öffentlichkeit diese Zahlen widerspiegelt, haben die Regulierungsbehörden einen langen Weg vor sich, um das Vertrauen in ihre Entscheidungsprozesse zurückzugewinnen.
Aufnahme?
Trotz der anhaltenden Verbreitung von Auffrischungsimpfungen scheint die Begeisterung für die Impfstoffe nachzulassen. Die Covid-19-Impfstoffe sind nicht so wirksam bei der Verhinderung von Infektionen und Übertragungen wie ursprünglich erhofft, und bei einem so geringen Risiko einer schweren Erkrankung bei Kindern sind die Eltern weniger überzeugt.
A aktuelle US-Umfrage fand heraus, dass fast ein Drittel der Eltern von Kindern unter 5 Jahren sagte, dass sie ihr Kind „auf keinen Fall“ überhaupt impfen lassen würden, weitere 11 % gaben an, dass sie dies nur tun würden, wenn es erforderlich (obligatorisch) ist, und 38 % planten, in der Reihenfolge zu warten um zu sehen, wie der Impfstoff bei anderen wirkte.
Pfizer muss seinen Antrag bei der FDA für einen Drei-Dosen-Impfstoff für Kinder unter 5 Jahren noch einreichen, wird dies jedoch voraussichtlich in den kommenden Wochen tun.
Ursprünglich gepostet auf dem Autoren am Standort
Veröffentlicht unter a Creative Commons Namensnennung 4.0 Internationale Lizenz
Für Nachdrucke setzen Sie bitte den kanonischen Link wieder auf das Original zurück Brownstone-Institut Artikel und Autor.









