Seit Beginn der Pandemie wurde uns versichert, dass die Einhaltung der Community-Maskierung unsere Probleme lösen und die Ausbreitung von SARS-CoV-2 stoppen würde. Doch reale Anwendungsdaten haben durchweg gezeigt, dass sie als Minderungsmaßnahme für den Personenschutz versagen, und anstatt den Kurs auf der willkürlich verteilten Anleitung zu korrigieren, wurde uns gesagt, dass wir es tun sollten Maske" Schwerer mit zunehmend restriktiven, wenn auch effektiv nicht mildernden Apparaten.
Jedoch müssen auch warum sind sie gescheitert, und warum scheitern sie weiterhin? Im Folgenden gehen wir auf die Einzelheiten ein, warum N95 die Ausbreitung von SARS-CoV-2 nicht eindämmen können, selbst wenn man von einer hypothetischen perfekten Erfassungskapazität ausgeht.
Wir sollten damit beginnen, die virale Übertragbarkeit und den Ausstoß von infektiösem Material als Spektren zu betrachten, basierend auf der Schwere der Krankheit, der Immunantwort einer bestimmten Person und dem Fortschritt im Krankheitsverlauf. Es hat sich gezeigt, dass diese alle erhebliche Auswirkungen auf die Viruslast einer mit SARS-CoV-2 infizierten Person haben. Wir werden Ausgangszahlen im Vergleich zu Infektionsraten und Messmethoden für die minimale Infektionsdosis diskutieren.
Dies sind jeweils wichtige Faktoren, die bei der pathogenen Minderung auch unabhängig voneinander berücksichtigt werden müssen, aber zusammengenommen können sie uns genau zeigen, ob ein bestimmter Ansatz das gewünschte Ergebnis bei der Beseitigung einer Infektionsgefahr hat. Die Ausgangszahlen der Atemwegsemissionen zeigen, wie viel Materie von einer Person ausgestoßen wird und ob sie mit einem Atemwegserreger übertragbar sind oder nicht, aber die Ausgangszahlen variieren stark zwischen schwereren Stadien beim Ausbruch der Krankheit, Erholungsphasen und PCR-negativ für einen bestimmten Erreger.
Durch den Vergleich des Outputs mit dem Verhältnis von Partikel zu Plaque bildender Einheit (PFU) erhalten wir eine Rate, wie viele emittierte Partikel lebensfähige Virionen sind, die Infektionen verursachen können. Jede dieser infektiösen Einheiten wird als PFU bezeichnet. Die Anzahl der PFUs, die ein potenzieller Wirt erhalten muss, wird als minimale Infektionsdosis (MID) angegeben, bei der es sich um einen Schwellenwert handelt, bei dessen Erreichen der Beginn einer Infektion zu erwarten ist.
Wenn man sich die Zahlen für das Partikel-zu-PFU-Verhältnis ansieht und das MID-Potenzial berechnet, ist das Endprodukt die potenzielle Anzahl von Personen, die über einen bestimmten Zeitraum infiziert werden können.
Mit diesem MID-Schwellenwert für das Infektiositätspotenzial können wir dann die hypothetische perfekte Erfassungskapazität eines bestimmten Geräts anwenden, um zu sehen, ob das Best-Case-Szenario zu einer Wahrscheinlichkeit führt, dass das Gerät die Gefahr mindert oder verhindert, dass der MID-Schwellenwert erreicht wird.
Hier betrachten wir die Ausgabe, das Partikel-zu-PFU-Verhältnis und die MID für SARS-CoV-2 im Vergleich zur hypothetischen perfekten Aufnahmekapazität für N95, um zu zeigen, dass selbst bei einer perfekten Aufnahmerate (und in diesem Fall von Materie, die viel kleiner ist, als das Gerät zum Auffangen zugelassen oder ausgelegt ist), sind die 5 % Prozent, die nie aufgefangen werden, immer noch eine potenzielle Exposition gegenüber infektiösem Material, die reichlich genug ist, um zu einer Infektion zu führen.
Partikelreichweite und entsprechendes Verhalten emittierter Materie
Maßnahmen zur Eindämmung der Pandemie hätten mit einer minimal lebensfähigen Partikelgröße beginnen sollen, die für SARS-CoV-2 bei 0.06–0.14 µm liegt. Obwohl häufig von Beamten des öffentlichen Gesundheitswesens gedrängt, sind N95 nur für die Erfassung von Materie mit einer Größe von mehr als 0.3 µm ausgelegt und zugelassen. Es wurde gezeigt, dass mehr als 90 % der ausgeatmeten Partikel abfallen für 0.3 um. Diese Größe von Materie bleibt für längere Zeit in der Luft – Stunden, sogar Tage, je nach Luftaustauschrate innerhalb des gegebenen Raums. Es hat sich gezeigt, dass SARS-CoV-2 nach Stunden als Aerosol außerhalb eines Wirts und tagelang auf Oberflächen lebensfähig bleibt.
"Der SARS-CoV-2 Virus festgestellt wurde 3 Std. lebensfähig. in Aerosolen, mit Abnahme der infektiösen Viruskonzentration ab 103.5 zu 102.7 TCID50 pro Liter Luft.“
Diese Studie verwendete im Labor hergestellte Aerosole, die infektiöses SARS-CoV-2 enthielten, und beobachtete die Lebensfähigkeit der emittierten Materie auf verschiedenen Oberflächen und als Aerosole im Laufe der Zeit.
Bei der Betrachtung des Folgenden fragt man sich auch, ob poröse Masken- und Beatmungsmembranen eine Rolle bei der Erhöhung der Lebensfähigkeitsdauer für virale Materie gespielt haben:
"Die Überlebenszeiten von luftübertragenen Viren auf Oberflächen unterscheiden sich basierend auf ob die Oberflächen nicht porös (z. B. Kunststoff, Edelstahl, Glas) oder porös (z. B. Papiere und Kleidung) sind. Nicht poröse Oberflächen tragen wesentlich zur Übertragung von Krankheiten bei, da beobachtet wurde, dass die Überlebenszeiten von luftübertragenen Viren auf ihnen viel länger sind als die von porösen Oberflächen.“
Masken und Atemschutzgeräte zählen sicherlich zu den porösen Oberflächen. Viele Atemschutzgeräte sind auch aus schmelzgeblasenem Kunststoff hergestellt. Ist die virale Lebensfähigkeit auf Maskenmembranen ausreichend untersucht worden?
Aerosollebensfähigkeitsraten sind wichtig, weil sie die Fähigkeit zur Übertragung in geschlossenen Räumen zeigen, ohne dass eine übertragbare Person anwesend ist. Mit der ein übertragbares Individuum vorhanden ist und in den gegebenen Raum emittiert, wäre die Ausgabe konstant, und lebensfähige virale Materie würde die atmosphärische Sättigung des Pathogens pro Atemzug erhöhen.
Ein übersehenes, aber kritisches Problem bei Masken und Atemschutzgeräten ist die Abdichtung – kleine Spaltbereiche machen diese Geräte für den Träger unwirksam. Selten, wenn überhaupt, trägt jemand diese Apparate korrekt unter den erforderlichen Tragebedingungen, so dass wir auf bereits nicht mildernde Apparate stoßen, die falsch getragen werden.
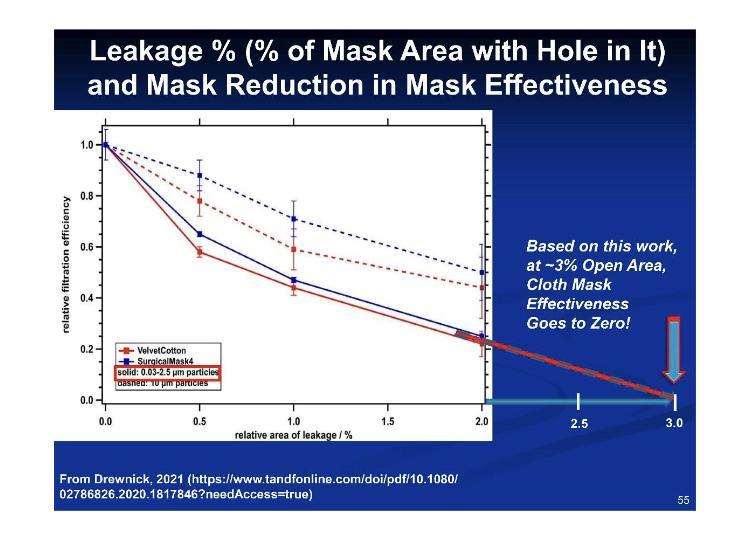
Gemäß diesen Zahlen für Passform versus Leckage entsprechen 3.2 % Leckage 100 % Ineffizienz.
Dies sind alles Faktoren, die berücksichtigt werden müssen, wenn die Ursache dafür angegangen wird, dass ein Gerät eine bestimmte Gefahr nicht mindert. Indem wir als Nächstes die Emissionen, die minimale Infektionsdosis, Plaque-bildende Einheiten und ihre Beziehung untersuchen, können wir besser verstehen, warum technische Kontrollen immer die richtige Antwort waren und nicht die Massenimplementierung von Atemschutzgeräten.
Atmungsemissionen von „kranken“ Patienten – PCR-positive versus negative Testergebnisse:
Bei Untersuchungen zum Aerosolausstoß bei gesunden im Vergleich zu SARS-CoV-2-PCR-positiven Testpersonen lagen über 90 % der von PCR-positiven Testpersonen emittierten Partikel unter 0.3 µm, und es wurden Zählungen der emittierten Materie durchgeführt, bei denen Personen mit unterschiedlichen Schweregraden verglichen wurden Krankheit mit PCR-negativen Probanden.
"Der Median atmete aus Die Partikelzahl war bei SARS-CoV-2-PCR-positiven Patienten (1490.5/l [46.0–34,772.0/l]) im Vergleich zu gesunden Kontrollpersonen (252.0/l [0.0–882.0/l]; p < 0.0001) hochsignifikant erhöht.“
Wenn wir eine Atmungsemissionsrate von 4.3–29 Litern pro Minute (aus dem EPA Exposure Factors Handbook) verwenden, beträgt der PCR-positive Bereich mit der höchsten Ausgabe von 34,772 Partikeln pro Liter multipliziert mit 29 Litern pro Minute bis zu 1,008,388 Partikel, die pro Minute emittiert werden .
Obwohl ich nicht behaupte, dass all diese Partikel einzelne Viruspartikel oder lebensfähige Viruspartikel waren, gibt es dennoch einen hochsignifikanten Unterschied in der von PCR-positiven und -negativen Personen emittierten Materie (Medianwerte von 1,490.5 gegenüber 252). Ein Verhältnis für die Umwandlung von Partikeln in PFUs wird eingeführt, nachdem die Rolle von PFUs diskutiert wurde.
Partikelgrößen und Emissionsraten:
In der zuvor erörterten Studie wurden die Größenbereiche der emittierten Partikel bei SARS-CoV-2-positiven und -negativen Probanden besprochen.
"Apropos Teilchen Größenverteilung wurden die verfügbaren Größenkanäle (insgesamt 14 Größenkanäle von 0.15 bis 5.0 μm) in drei Größenbändern analysiert: <0.3 μm, 0.3–0.5 μm und >0.5–5.0 μm. Bei beiden Gruppen wurde der Großteil der Aerosole (> 90 % in der SARS-CoV-2-PCR-positiven Gruppe und > 78 % in der -negativen Gruppe) im kleinsten Bereich (< 0.3 μm) gefunden. Insbesondere in der COVID-positiven Gruppe wurde der Anstieg der Gesamtaerosolkonzentration von einem Anstieg der Partikel ≤0.3 μm dominiert.“
Zehn Personen der 64 untersuchten Krankenhauspatienten, die zu den schwersten Fällen gehörten, waren für etwa 64.8 Prozent der ausgeatmeten Partikelzahlen verantwortlich, daher ist es in diesem Fall wichtig, sich das anzusehen am wenigsten konservativer Ausgabebereich und das Potenzial für Infektiosität bei der Ausführung von Ausgabe- und minimalen Infektionsdosisberechnungen. Konkret hieß es in dem Papier:
"Bei SARS-CoV-2 15.6 % (n = 10/64) der PCR-positiven Gruppe zeigten hohe Zahlen und waren für 64.8 % aller ausgeatmeten Partikelzahlen in der Gruppe verantwortlich. Darüber hinaus waren die 15.6 %, was 3.5 % aller Patienten (n = 10/288) entspricht, für 51.2 % aller ausgeatmeten Partikel verantwortlich.“
Wenn wir diejenigen mit der größten Krankheitsschwere mit den Infektiositätsraten vergleichen, können wir mehr über den Ausstoß lebensfähiger Partikel durch übertragbare Personen erfahren. In Anbetracht des geringen Ausstoßes sowohl von emittierter Materie als auch von Virionen durch PCR-negative und genesende PCR-positive Testpersonen kann man mit Sicherheit spekulieren, dass dies auf die geringe Wahrscheinlichkeit hindeutet, dass eine asymptomatische Übertragung ein Hauptfaktor für die Virusausbreitung ist.
Das Vorhandensein von RNA-Kopien im Vergleich zu Konzentrationen lebensfähiger Virionen
Nicht alle RNA-Kopien oder Viruspartikel sind in der Lage, PFUs zu bilden, was zu einer viralen Replikation führt. Während Daten darüber bereitgestellt wurden, wie viele infektiöse Einheiten erzeugt werden, ist dies der Fall nicht die Emissionsausstoßrate. Dies sind Schätzungen der gesamten Virusproduktion während einer Infektion.
"Division durch Schätzungen für den Kehrwert der viralen Clearance-Rate ergibt sich eine geschätzte Gesamtproduktion von 3 × 109 bis 3 × 1012 Virionen oder 3 × 105 bis 3 × 108 Infektionseinheiten über den gesamten Verlauf einer charakteristischen Infektion.“
Vereinfacht gesagt ist das eine Gesamtproduktion von 3 Milliarden bis 3 Billionen Viruspartikeln oder 300,000 bis 300 Millionen infektiösen Einheiten, die im Laufe einer Krankheit erzeugt werden.
Virion-Ausgabe
Es gibt verschiedene Methoden zur Bestimmung des Virion-Outputs, die nebeneinander betrachtet leicht unterschiedliche Bereiche bieten. Einige Studien zeigen die Gesamtzahl der emittierten Virionen, wie z. B. die folgenden:
"Einige Patienten haben virale Titer, die den durchschnittlichen Titer von Wölfel et al. um mehr als zwei Größenordnungen übersteigen, wodurch die Anzahl der Virionen in den emittierten Tröpfchen auf weit über 100,000 pro Sprechminute erhöht wird.“
Andere Studien geben Gesamtpartikelzahlen an und verlassen sich auf die Verwendung von Umrechnungsfaktoren von der Gesamtausgabe zu lebensfähigen Virionen. Es ist wichtig festzuhalten, dass der Gesamtausstoß von Viruspartikeln nicht gleich der Gesamtzahl lebensfähiger Virionen ist, d. h. Virionen, die in der Lage sind, Plaque-bildende Einheiten (PFU) zu bilden.
PFUs – Verständnis von Viruspartikeln, die zur Bildung individueller Plaque Forming Units (PFU) benötigt werden:
Obwohl nicht alle emittierten viralen RNA und Viruspartikel zur viralen Replikation und zur Bildung von PFUs fähig sind, versteht es sich, dass jede PFU von einem lebensfähigen Viruspartikel erzeugt wird. In den folgenden Auszügen werden die Auswirkungen von PFUs auf Virusinfektionen und deren Ausbruch erörtert.
"Der Assay ist entworfen so dass jede Plaque aus einer Infektion entsteht, indem ein einzelnes infektiöses Viruspartikel vermehrt wird. Als solches wird PFU/ml als Maß für die Anzahl infektiöser Einheiten pro Milliliter (IE/ml) betrachtet, mit der Einschränkung, dass man sich nicht auf ein Eins-zu-eins-Verhältnis von Plaques zu infektiösen Partikeln in der aufgetragenen Aliquote verlassen kann. ”
"Für die meisten tierischen Viren, genügt ein infektiöses Partikel, um eine Infektion auszulösen.“
"Die lineare Natur der Dosis-Wirkungs-Kurve zeigt an, dass ein einzelnes Virion in der Lage ist, eine Infektion auszulösen. Das hohe Partikel-zu-pfu-Verhältnis vieler Viren zeigt jedoch, dass nicht alle Virionen erfolgreich sind. Ein hohes Partikel-zu-pfu-Verhältnis wird manchmal durch das Vorhandensein von nicht infektiösen Partikeln mit Genomen verursacht, die tödliche Mutationen enthalten oder die während des Wachstums oder der Reinigung beschädigt wurden.“
"Es wird allgemein angenommen dass eine Plaque das Ergebnis der Infektion der Zelle durch ein einzelnes Virion ist. Wenn dies der Fall ist, sollten alle Viren, die aus Viren in der Plaque produziert werden, ein Klon sein, mit anderen Worten, sie sollten genetisch identisch sein.“

Zusammenfassend ist ein lebensfähiges Viruspartikel oder Virion in der Lage, eine PFU zu erzeugen, in der sich dieses Viruspartikel repliziert. Ein Teil der erzeugten Materie ist ausschließlich virale RNA, die nicht in der Lage ist, unabhängig eine Infektion zu verursachen, und ein Teil der erzeugten Materie ist zur Replikation und Infektion fähig.
Die Beziehung zwischen Der Gesamtausstoß an Partikeln und die Bildung von PFUs wird als Partikel-zu-PFU-Verhältnis bezeichnet. Bei SARS-CoV-2 beträgt das Verhältnis von emittierten Partikeln zu PFUs 1000 zu 1,000,000.
Studien zu PFU und minimaler infektiöser Dosis
Unsere Atemfrequenz variiert je nach Alter und Aktivitätsgrad. Die durchschnittliche menschliche Atemfrequenz beträgt 16-20 Atemzüge pro Minute. Für die Zwecke dieser Diskussion wird eine Atemfrequenz von 4.3 bis 29 Liter pro Minute (aus dem EPA Exposure Factors Handbook) verwendet. Diese Referenz gibt eine Reichweite von bis zu 53 Litern pro Minute an. Wir werden den Output als Virionen pro Minute und die minimale Infektionsdosis als PFUs und Virionen für die Übertragung untersuchen, da beide in der verfügbaren Forschung untersucht werden.
Daten zur minimalen Infektionsdosis (MID) aus der Literatur:
Vergleichsstudien verschiedener Atemwegsviren und SARS-CoV-2-Tierstudien wurden verwendet, um zu vielen MID-Schätzungen beizutragen, aber dieses Papier konzentriert sich so weit wie möglich ausschließlich auf Studien am Menschen.
"Obwohl die MID von SARS-CoV-2 beim Menschen braucht mehr Forschung, es wird mit etwa 100 Viruspartikeln gerechnet. Die einzige Humanstudie zu einem Coronavirus wurde für HCoV-229E gemeldet, und seine MID beträgt 9 PFU. Wenn die Aerosolübertragung der vorherrschende Modus ist, wäre der MID außerdem niedriger.“
"Tatsächlich, Infektionen auf Aerosolbasis weniger Dosen benötigen, z. B. ~100-mal weniger als tröpfchenbasierte Infektionen.“
"Die minimale Infektionsdosis von SARS-CoV-2, das COVID-19 beim Menschen verursacht, war in bewerteten Querschnitts- und Fallserienstudien gering; In einer Fallserienstudie, in der die Infektionsdosis in 273 Proben von 15 SARS-CoV-2-positiven Patienten untersucht wurde, betrug die nachgewiesene minimale Infektionsdosis in vitro im COVID-1.26-RdRp/Hel-Assay 19 PFU.1 In einer anderen Studie 248 oronasopharyngeale Proben von COVID-19-Personen wurden bewertet, und die infektiöse Dosis wurde mit 364 PFU angegeben.“
"In einer Fallserienstudie die 97 Kinder im Alter von 10 Jahren und jünger, 78 Kinder im Alter von 11–17 Jahren und 130 Erwachsene untersuchten, war die Infektionsdosis bei Kindern im Alter von 11–17 Jahren niedriger als in zwei anderen Gruppen (125 PFU). Kinder hatten im Vergleich zu Erwachsenen ein geringeres Lebendviruswachstum, höhere Zyklusschwellen und eine niedrigere Viruskonzentration, sodass Kinder nicht die Hauptüberträger von Infektionen sind. Kinder im Alter von ⩽10 Jahren waren eher asymptomatisch als andere.“
"Eines der am meisten Eine gut diskutierte (sic) ist die von Basu et al. durchgeführte Studie, deren Hauptziel darin bestand, die Größe der Tröpfchen zu bewerten, die mit hoher Wahrscheinlichkeit eine Infektion verursachen. Aber neben diesem Befund hatten sie auch einige Punkte im Zusammenhang mit der Viruslast, die die Infektion verursachen können. Sie fanden heraus, dass die Anzahl der Virionen, die sich über einen Zeitraum von 2.5 h im Nasopharynx einer nahe gelegenen Person platzieren, ungefähr (11/5) Virionen pro Minute × 60 min × 2.5 h = 330 entspricht.“
Vergleichsstudien mit anderen Coronaviren haben gezeigt, dass PFUs für Atemwegsviren recht niedrig sein können.
"Geschätzte Infektiosität von SARS-CoV-1 war vergleichbar mit anderen Coronaviren, einschließlich HCoV-229E, einem Erreger einer leichten Erkältung beim Menschen. ID10 und ID50 von SARS-CoV-1 wurden in einer experimentellen Studie als 43 und 280 PFU (400 TCID50) angegeben.“
"Die menschliche ID50 für den saisonalen Coronavirus-Subtyp 229E, der beim Menschen eine leichte Erkältung verursacht, wurden 13 TCID angegeben50"
Die in den bereitgestellten Studien zu SARS-CoV-2 diskutierten Zahlen waren 1.26, 100, 125, 330 und 363 PFU für die Übertragung, was wiederum für ein breites Spektrum an Anfälligkeit spricht.
Ausgabe lebensfähiger Virionen im Vergleich zum Schwellenpotential der minimalen Infektionsdosis
Durch die Verwendung dieser verfügbaren Zahlen können wir die Behauptung angehen, dass N95 einen bedeutenden Schutzwert vor infektiösen Aerosolen bieten, indem wir die Beiträge zum Output, das Infektionspotenzial der emittierten Virussubstanz und die PFU-Bereiche betrachten, und dann können wir diese Bereiche gegen eine hypothetische perfekte Aufnahmekapazität von N95 abwägen Erfasst 95 % der Materie, gegenüber den verbleibenden nicht erfassten 5 %. Beachten Sie noch einmal, dass N95 nicht dafür ausgelegt oder zugelassen sind, <0.3 µm einzufangen, und wir diskutieren einen Krankheitserreger, der eine lebensfähige Mindestpartikelgröße von 0.06-0.14 µm hat.
Atemwegsemissionen von einer übertragbaren Person mehr als 100,000 Virionen in einer Minute erreichen, obwohl nicht alle emittierten Virionen als infektiös angesehen werden können. Weitere Forschungsarbeiten haben eine Leistung von bis zu 750,000 Virionen/Minute behauptet (es fehlen jedoch Daten, die solche Behauptungen stützen). Es sollte auch beachtet werden, dass wir natürlich nicht alle ausgeatmeten Substanzen einer Person einatmen, aber unsere Nähe zu einer übertragbaren Person, ihre Ausstoßrate, die Dauer innerhalb des Raums und die Belüftung innerhalb dieses Raums sind alles Faktoren, die haben werden eine Auswirkung auf die Übertragungswahrscheinlichkeit, die nicht linear oder vorhersehbar ausgedrückt werden kann.
In der Studie Wie wir oben untersucht haben, lag der PCR-Positivbereich mit der höchsten Leistung bei 34,772 Partikeln pro Liter, wobei diejenigen, die die höchsten Leistungsbereiche emittieren, 64 Prozent der gesamten emittierten Materie ausmachen.
Zuerst werden wir erstellen eine stündliche Ausgabe von jedem dieser Bereiche, dann wenden Sie das Partikel-zu-PFU-Verhältnis für jeden Bereich von 1,000 bis 1,000,000 an.
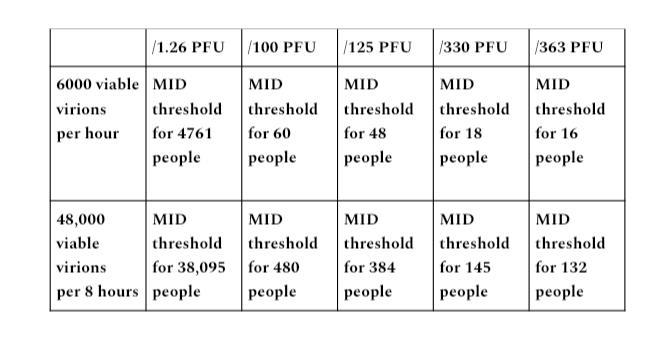
Ausgangsbereich A
Eine Stunde eines übertragbaren Individuums in einem geschlossenen Raum, das 100,000 Virionen pro Minute emittiert, wäre ein Output von 6 Millionen Virionen (100,000 × 60 Minuten). Ein Zeitraum von 8 Stunden in einem geschlossenen Raum entspricht 48 Millionen emittierten Virionen (100,000 × 480 Minuten). Bei einem Partikel-zu-PFU-Verhältnis von 1,000 zu 1,000,000 ergibt dies 6,000 lebensfähige Virionen in einer Stunde, 48,000 in 8 Stunden.
Die angegebenen PFU-Zahlen aus den diskutierten Studien waren 1.26, 100, 125, 330 und 363 PFU, die als minimale Infektionsdosis erforderlich waren. Ich habe jede Menge lebensfähiger Virionen durch jede PFU-Zahl geteilt, um jedes Potenzial für den MID-Schwellenwert aufzulisten.
Ausgangsbereich B
In der PCR-positiven Partikelsammlungsstudie waren 34,772 Partikel pro Liter der höchste gesammelte Bereich, wobei ~64 % Prozent der insgesamt emittierten und gezählten Partikel aus 10 Quellen stammten, die zu den am stärksten von ihrer Infektion mit SARS-CoV-2 betroffenen gehörten . Betrachtet man 34,772 Partikel multipliziert mit einer Emissionsmenge von 29 Litern pro Minute, ergibt sich eine Leistungsspanne von bis zu 1,008,388 emittierten Partikeln pro Minute.
Das EPA Exposure Handbook listet einen Minutenbereich von bis zu 53 Litern pro Minute auf, sodass die Verwendung einer Zahl von 29 Litern pro Minute nicht der höchstmögliche Leistungsbereich ist. Die Leistungsbereiche von 7 und 29 Litern pro Minute werden verwendet, da es sich um Leistungsbereiche handelt, die in die Bereiche sitzender bis mittelschwerer Aktivität fallen.
Bei 29 Litern pro Minute multipliziert mit 34,772 Partikeln pro Liter (1,008,388 Partikeln) für eine 60-minütige Ausgabedauer beträgt das Produkt 60,503,280 (1,008,388 × 60) Partikel pro Stunde und 484,026,240 pro 8-Stunden-Periode (1,008,388 × 480). Protokoll).
Bei einem Partikel-zu-PFU-Verhältnis von 1,000 zu 1,000,000 für COVID ergibt dies 60,503 lebensfähige Virionen, die pro Stunde emittiert werden, und 484,026 lebensfähige Virionen pro 8-Stunden-Zeitraum.
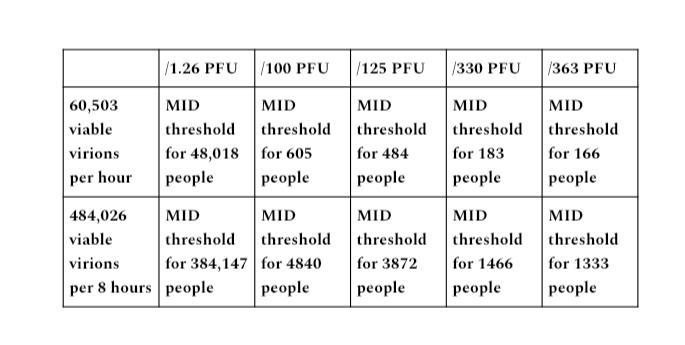
Diese Berechnungen geben uns das Produktionspotenzial einer übertragbaren Person nicht nur in Bezug darauf, wie viele Viruspartikel emittiert werden, sondern auch in Bezug auf das Potenzial, den MID-Schwellenwert zu erreichen, um eine bestimmte Anzahl von Menschen zu infizieren, basierend auf der verwendeten PFU-Zahl.
Während das für SARS-CoV-2 nachgewiesene PFU-Spektrum recht breit ist, sollten wir je nach individuellem Gesundheitszustand und Immunantwort mit einem Spektrum an Übertragbarkeit rechnen. Während 1.26 PFU ziemlich niedrig erscheinen, hat sich gezeigt, dass die PFU für SARS-Cov-1 nur 13 PFU beträgt, um den MID-Schwellenwert für den Beginn einer Infektion zu erreichen.
Selbst wenn eine geringere Emissionsleistung von 7 Litern pro Minute verwendet wird, ergibt dies eine Rate von 243,404 Partikeln pro Minute (34,772 x 7)), 14,694,240 Partikeln pro Stunde (234,404 x 60) und 116,833,920 (243,404 x 480) Partikeln pro 8 - Stundenperiode. Bei einem angewendeten Partikel-zu-PFU-Verhältnis von 1,000 bis 1,000,000 ergibt ein Zeitraum von einer Stunde 1 lebensfähige Virionen und 14,604 in einem Zeitraum von 116,833 Stunden.

Mit diesen Leistungsbereichen von sitzender bis mäßiger Intensität wird der MID-Schwellenwert für alle etablierten PFU-Werte oft erreicht.
Warum N95s ausgefallen sind / ausfallen / ausfallen werden
Atemschutzgeräte mit einer N95-Einstufung sind so konzipiert und zugelassen, dass sie 95 % der nicht auf Öl basierenden Stoffe mit einer Größe von mehr als 0.3 µm auffangen. SARS-CoV-2 hat eine minimal lebensfähige Partikelgröße von 0.06-0.14 µm, weit unter der Schwelle von 0.3 µm, selbst wenn es an größere Materie gebunden ist, so dass dies eine hypothetische perfekte Aufnahmekapazität für einen Partikelbereich ist, für den diese Geräte nicht ausgelegt sind oder für die Erfassung zugelassen sind, noch haben ihre Anwendungsdaten gezeigt, dass sie eine Leistung von 95 % oder nahe daran haben.
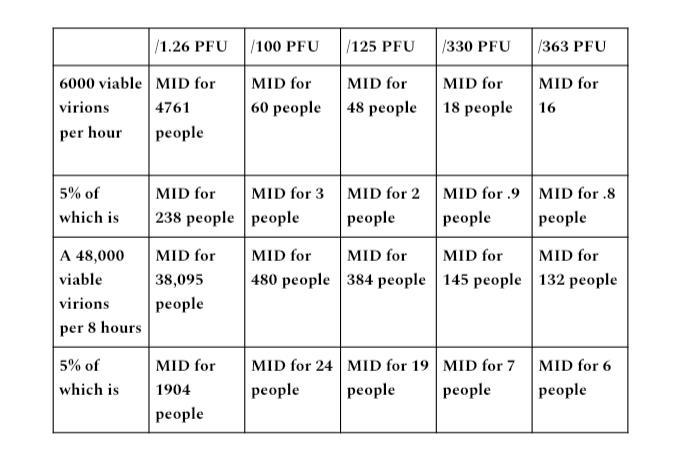
Zum Zweck einer Übung in Bezug auf die hypothetische perfekte Erfassungskapazität werden wir ihnen eine Annahme einer perfekten Erfassungsrate von 95 % gewähren. Wenn wir 5 % der MID-Zahlen, die in demonstriert wurden, auf die Ausgangsbereiche A und B anwenden, zeigt dies die Infektiosität lebensfähiger Virionen im Vergleich zu den 5 % Prozent, die nie eingefangen wurden (z. B. kein Auslaufen), wenn eine hypothetische 95-prozentige perfekte Rate von Erfassung erfüllt ist.
Ausgangsbereich A
Ausgangsbereich B
29 Liter pro Minute
7 Liter pro Minute
Wenn wir eine hypothetische perfekte Erfassungskapazität für N95 von Partikelgrößenbereichen von Materie annehmen, für deren Erfassung diese Geräte nicht ausgelegt oder zugelassen sind, und die verbleibenden 5 % Prozent nie erfasst werden, ist die überwiegende Mehrheit der Leistungsbereiche gegenüber PFU erforderlich, um die MID zu erfüllen Der Schwellenwert erlaubt immer noch eine Exposition gegenüber einem Vielfachen des MID-Schwellenwerts für eine potenzielle Infektion vieler Personen in 1-Stunden- und 8-Stunden-Zeiträumen für jeden etablierten Leistungsbereich.
Zusammenfassung
Während des SARS-CoV-2-Ausbruchs wurden wir mit unseren Minderungsstandards nachlässig, da dieser Erreger für die überwiegende Mehrheit der Menschen nicht tödlich ist, mit einer Überlebensrate von rund 99.8 %. Diese Leichtfertigkeit in Richtung einer gefahrenspezifischen Reaktion ist unglaublich gefährlich, wenn sie auf tödlichere Krankheitserreger und Expositionselemente angewendet wird.
Durch die Untersuchung des hypothetischen Best-Case-Szenarios können wir besser vorhersagen, ob eine bestimmte Maßnahme eine mildernde Wirkung auf die identifizierte Gefahr haben wird. Für N95 im Vergleich zu Output, Partikel-zu-PFU-Verhältnissen und MID für SARS-CoV-2 zeigt das Best-Case-Szenario einer hypothetischen perfekten Erfassung von Materie, für deren Erfassung diese Geräte weder ausgelegt noch zugelassen sind, dass sie immer noch nicht mildernd sind diese Gefahr, und Empfehlungen für ihre Verwendung sollten sofort überdacht werden.
Zusätzliche Ressourcen:
Erläutert die durchschnittliche Viruslast aus Proben: https://www.nature.com/articles/s41586-020-2196-x.
Minimale Infektionsdosis
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7090536/ (auf MID im Allgemeinen, nicht SARS-CoV-2 spezifisch).
Glossar
Sprühdose – Partikel, die in Luft oder Gas dispergiert sind und eine Größe von weniger als 5 Mikrometer haben.
asymptomatisch (Ausbreitung) – das theoretische Konzept, einen Krankheitserreger auf andere zu übertragen, ohne dass nachgewiesene Symptome dieses Krankheitserregers auftreten.
atmosphärische Sättigung – die Menge lebensfähiger Materie, die in der Luft in einem geschlossenen Raum verbleibt.
Emissionen – ausgeatmetes Atemmaterial.
Laminar-Flow-Regime – Flüssigkeitspartikel, die in Schichten glatten Bahnen folgen.
minimale Infektionsdosis – das Mindestmaß an Gefährdung, dem man ausgesetzt sein muss, um mit dem Ausbruch einer Krankheit zu rechnen.
N95 - ein nicht ölaufnehmendes Atemschutzgerät mit Partikelfilter, das bis zu 95 % der Materie über 0.3 µm blockieren kann.
Beginn – der Beginn einer Krankheit, die sich ausbreitet, sobald die Mindestschwelle der Infektionsdosis erreicht ist.
Ausgang - die Emissionen, die von einer übertragbaren Person in eine bestimmte Umwelt freigesetzt werden.
Ausgabe als Konstante – eine Person in einem geschlossenen Raum, die mit infektiösen Partikeln beladene Atemaerosole in die gegebene Atmosphäre ausstößt und die gegebene Atmosphäre mit jedem Atemzug mehr mit infektiösem Material sättigt.
Partikel zu PFU-Verhältnis – ein Verhältnis für Berechnungen des pathogenen Outputs, das die Gesamtzahl der emittierten Partikel gegen die Partikel gewichtet, die lebensfähig infektiös sind.
PCR-negativ – ein bestimmtes Testsubjekt erhält kein positives Testergebnis, wenn es mit der PCR-Methode auf einen bestimmten Erreger getestet wird. PCR steht für die Verwendung der Polymerase-Kettenreaktionstechnik.
PCR-positiv – ein bestimmtes Testsubjekt erhält einen positiven Test, wenn es unter Verwendung der Polymerase-Kettenreaktionstechnik auf ein bestimmtes Pathogen getestet wird.
perfekte Fangleistung – Abscheidung von gefährlichen Stoffen mit einer entsprechenden prozentualen Wirksamkeit, die ein Produkt als seine hypothetisch bestmögliche Rate angibt.
Plaque-bildende Einheiten (PFUs) – Die Bildung von PFUs erfordert, dass ein Virion eine Wirtszelle infiziert, wo die virale Replikation beginnt. Für den Ausbruch einer Krankheit ist eine Schwelle von einer bestimmten Anzahl von PFUs erforderlich, die als minimale Infektionsdosis bekannt ist.
RNA-Kopien – genetisches Material, das benötigt wird, um Kopien von Proteinen innerhalb einer Zelle anzufertigen. RNA-Kopien sind nicht gleichbedeutend mit lebensfähigen Virionen, die zur Replikation fähig sind.
TCID50 – eine Abkürzung für Gewebekultur-Infektionsdosis, die die Verdünnung eines Virus ist, die erforderlich ist, um 50 % der Zellen in einem Kulturtest zu infizieren.
Viruslast - die Menge an Viruspartikeln in einer bestimmten Substanz, Emission oder im Körper einer übertragbaren Person.
virale Lebensfähigkeit – Virionen, die in der Lage sind, eine Zelle zu infizieren und Plaque-bildende Einheiten (PFUs) zu bilden.
Virion oder lebensfähiges Virion- ein vollständiges infektiöses Viruspartikel.
Veröffentlicht unter a Creative Commons Namensnennung 4.0 Internationale Lizenz
Für Nachdrucke setzen Sie bitte den kanonischen Link wieder auf das Original zurück Brownstone-Institut Artikel und Autor.









